
抗病毒治疗改善了HIV感染者的生活质量,但低病毒血症(low-level viremia ,LLV)的存在仍然会带来很多危害。
高度关注并认真面对LLV,才能知道如何避免和管理LLV。为此专门推出了5篇“HIV低病毒血症”系列文章。
上一篇文章中,我们介绍了不同国家LLV的流行病学数据,数据表明,规范化抗病毒治疗后,仍有1/5至1/3的HIV感染者出现低病毒血症。
这是本系列的第二期文章,我们将一起探讨HIV低病毒血症对病毒学疗效的影响。
目前,国内外各指南对LLV的定义不尽相同。与之类似的是,各指南对病毒学失败的定义也存在很大差异[1-6]。
既有病毒载量阈值上的差异,也有抗病毒治疗时间上的差异。具体的定义描述,可见下图。

从这张图中,不难发现WHO的定义相对更宽泛一些,而欧美指南和最新版的《中国艾滋病指南》对病毒学失败的定义更为严格一些。
各指南LLV定义不尽相同,关于LLV是否会增加病毒学失败风险的研究标准也就不尽统一,结果还存在一定争议。这里,我们从不同诊断标准的各国研究中,去探索下LLV与病毒学失败可能的关系。
LLV与病毒学失败
非洲多国研究
2018年,The Lancet Infectious diseases杂志上公布了南非一项多中心观察性研究结果[7]。分析发现,不论是首选方案还是替代方案,LLV的出现均与病毒学失败风险增加有关,并且病毒载量越高,病毒学失败的风险就越高。
这项研究纳入了南非57个临床中心的成年HIV感染者,研究人员采用Cox比例风险模型,对40,580名接受首选方案治疗和1,650名接受替代方案治疗的患者,分析了LLV与病毒学失败的相关性。
在患者启动抗病毒治疗后第6个月、12个月以及之后的每12个月,检测一次病毒载量。研究中的LLV与病毒学失败的定义均以WHO指南为标准。
整体而言,接受首选方案治疗且出现LLV的患者发生病毒学失败的风险,是实现病毒学抑制(HIV RNA<50拷贝/mL)患者的2.6倍(HR 2.6, 95%CI 2.5-2.8)。
按照病毒载量分组分析来看,随着LLV患者病毒载量的增加,其发生病毒学失败的风险也在增加。
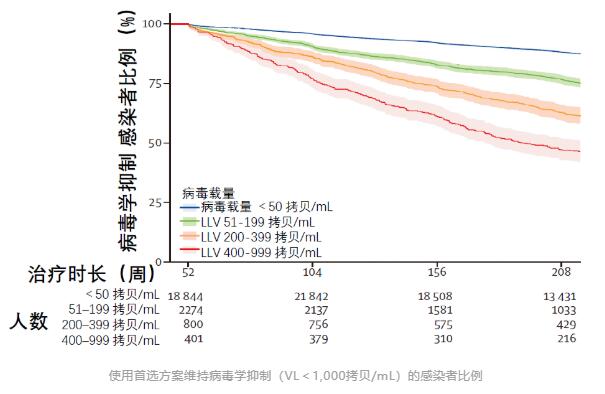
Cox 比例风险模型显示,病毒载量最高的400-999拷贝/mL组发生病毒学失败的风险,竟是病毒学抑制者的4.7倍。
即使是病毒载量最低的51-199拷贝/mL组,其发生病毒学失败的风险也比病毒学抑制组增加了90%。
替代方案治疗组也呈现出类似的结果。
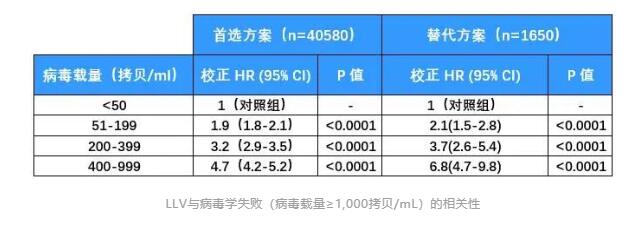
由此可见,LLV与病毒学失败风险增加的相关性不容小觑。
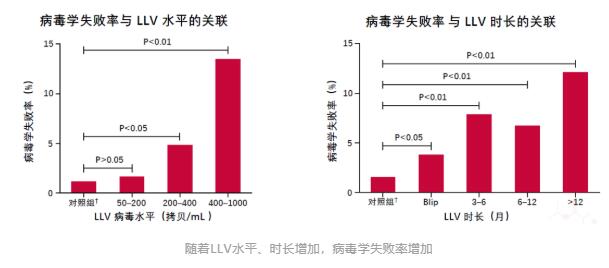
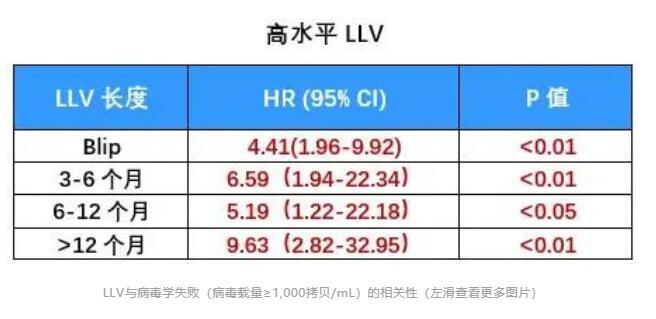
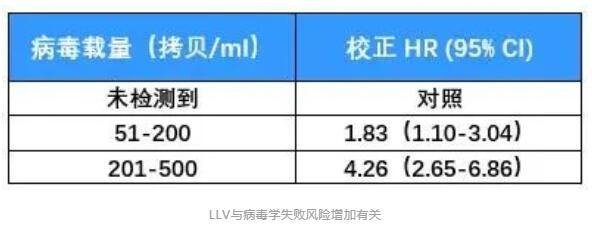
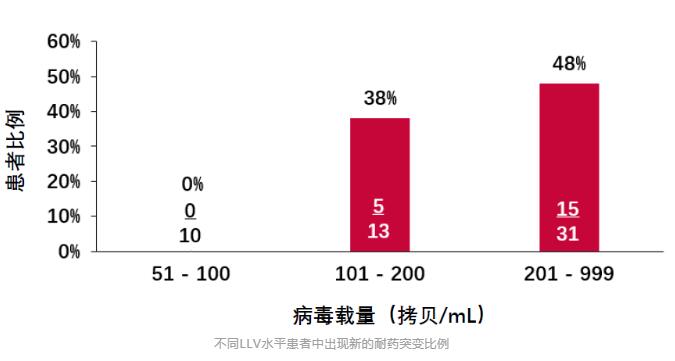
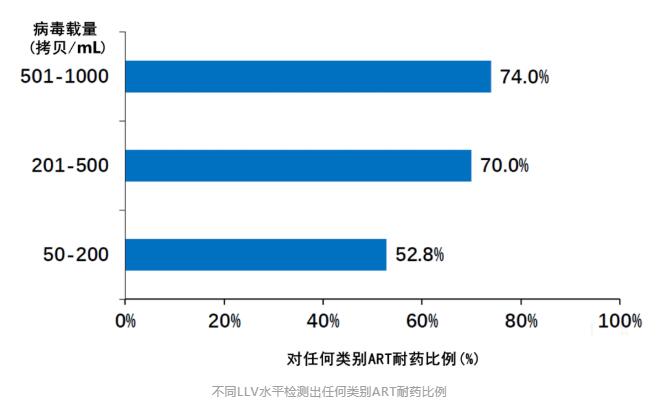
2019年刊登在Clinical Infectious Diseases杂志上的一项前瞻性队列研究,也给出了LLV与病毒学失败风险增加相关性的证据[8]。 这项研究纳入了乌干达、肯尼亚、坦桑尼亚和尼日利亚四国的1,511名HIV感染者。病毒学失败的定义仍以WHO指南为标准。 分析发现,与未检测到病毒载量的患者相比,持续性低病毒血症(pLLV)≥200拷贝/mL的患者发生病毒学失败的风险翻倍。 具体来说,Cox 比例风险模型显示200-499拷贝/mL的pLLV患者,病毒学失败风险增加81%;500-999拷贝/mL的pLLV患者,病毒学失败风险增加136%。 2020年,中国医科大学第一附属医院的研究团队发表了一篇回顾性研究,对LLV与病毒学失败风险的相关性做了更为详尽的研究[9]。 研究纳入了2,155名HIV感染者,他们均按照中国指南接受了一线抗病毒治疗。 LLV以WHO指南为标准,并进一步被划分为50-200拷贝/mL、200-400拷贝/mL和400-1,000拷贝/mL的低中高水平组。此外,研究人员还将任何水平LLV且伴随单次病毒载量>1,000拷贝/mL定义为高水平Blip组。 病毒学失败也以WHO指南为基础,定义为至少连续两次HIV RNA>1,000拷贝/mL。 在治疗过程中,患者每3-6个月随访一次评估治疗效果,以便研究者能够评估LLV持续时间与病毒学失败之间关系。 结果显示,随着LLV病毒载量的增加和持续时间的延长,病毒学失败率也在增加。 Cox比例风险模型分析表明,与病毒载量<50拷贝/mL的患者相比,高水平LLV组和高水平Blip组与病毒学失败风险增加有关,HR分别为5.93和2.84。 另外,随着LLV持续时间的延长,病毒学失败的风险也在增加。 美国研究 即使在发达国家的HIV感染者中,LLV的存在也仍与病毒学失败风险增加有关。 一项针对2,795名美国HIV感染者的研究给出了详细答案[10]。 本研究中,LLV定义为51-500拷贝/mL,分为51-200拷贝/mL组和201-500拷贝/mL组。病毒学失败定义为连续两次检测病毒载量超过500拷贝/mL。 分析发现,两组LLV均与病毒学失败风险增加有关。与未检测到病毒载量的患者相比,即使是51-200拷贝/mL的LLV组,其病毒学失败风险也增加了83%。 综合以上多国研究数据可以看出:按照WHO指南标准,在多数情况下,200-1,000拷贝/mL水平的LLV会增加后续出现病毒学失败的风险;而即使是51-199拷贝/mL水平的LLV也并非安全,病毒学失败的风险也可能随着时间延续而增加。 所以,LLV与病毒学失败风险增加的相关性不容忽视,应根据病毒载量高低,考虑更换治疗方案或加强持续监测。 LLV与耐药 另一个值得警惕的问题是LLV与耐药的关系。 持续的LLV意味着病毒仍在持续复制。如果抗病毒治疗方案不能完全抑制病毒复制,那么这是否会累积耐药相关突变、最终导致对治疗方案的耐药呢? 2011年,研究者对名为A5142和A5092的两项临床研究进行了回顾性分析[11],分析了LLV与耐药的相关性。 纳入分析的1,158名HIV感染者中,有65人出现了LLV。LLV定义为病毒载量高于50-999拷贝/mL。 其中54名患者在治疗前和LLV期间均有基因检测数据,他们中20个人检测到新的耐药突变,占比达到了37%。最常见的位点为M184I/V(n=14)、K103N(n=9)、M230L(n=3)。 进一步分析发现,新发耐药突变与LLV期间较高的病毒载量有关。 如下图所示,51-100拷贝/mL的10名患者中,均没有检测到新的耐药突变;101-200拷贝/mL的13名患者中,有5人出现新的耐药突变;而在>200拷贝/mL的31名患者中,有15人出现了新的耐药突变。 另一项对意大利HIV经治感染者的回顾性分析也表明,LLV病毒载量越高,基因测序成功率越高,并且病毒载量越高,耐药检出率越高[12]。 研究者对12,828份不同LLV水平的血浆样本进行了基因型耐药检测,这些血浆样本中的病毒载量在50-1,000拷贝/mL。 结果显示,出现LLV的HIV感染者,也可能通过基因性扩增/测序检测耐药突变,且LLV 水平越高,测序成功率越高。 进一步数据显示出现LLV的经治感染者中耐药率很高,尤其当VL>200拷贝/mL时,感染者对任何类别ART耐药率可达74%。不同水平LLV检出耐药的比例,可见下图。 这再一次表明,尽管病毒载量较低,但LLV者依然会出现耐药,这会影响抗病毒治疗的效果。 总之,不论是从病毒学失败风险增加考虑,还是从耐药考虑,都应该重视LLV。对于病毒载量在200-1,000拷贝/mL的HIV感染者,按照欧美及我国指南,需要考虑更换治疗药物;而对于不超过200拷贝/mL的LLV者,也应引起重视、加强监测,减少病毒学失败和耐药的发生。 以上就是本期LLV文章的主要内容,下一期文章中我们将一起讨论HIV低病毒血症的免疫和临床结局影响,欢迎届时阅读。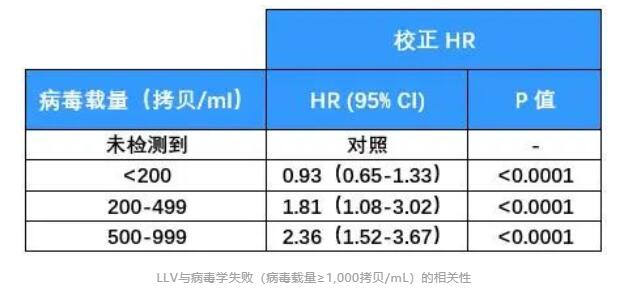
【责任编辑:阿杰 邮箱:xjpop@vip.qq.com】



